第五節 免疫透行射比濁法
當光線通過一個渾濁介質溶液時,由于溶液中存在混濁顆粒,光線被吸收一部分,吸收的多少與混濁顆粒的量成正比,這種測定光吸收量的方法稱為透射比濁法。這一方法早于1959年Schultre和Schuick等報道應用于血漿蛋白與其抗體結合后形成復合物,導致濁度的改變,再進行透射比濁測定,一般采用抗體對抗原定量的透射比濁法,稱為免疫透射比濁法。其原理是,利用抗原和抗體的特異性結合形成復合物,通過測定復合物形成量的多少對抗原或抗體進行定量的方法。在介質溶液中,抗原與特異性抗體在一定條件下才能形成復合物,一定的條件包括:①對抗體的要求,作為體液或組織中蛋白質種類很多,若要快速特異檢測,要求有單價特異抗體才能與抗原形成復合物。某一種蛋白質,有其特異抗體才能與該抗原結合,形成免疫復合物進行定量,若抗體不純混雜有另一種或兩種少量的抗體,這種免疫復合物就不是單一復合物而是大雜燴,結果偏高;②抗原抗體比例適當,因免疫復合物形成有三個階段,第一階段是復合物形成抗原抗體復合物;第二階段是初步形成抗原抗體復合物,此階段是復合物交聯成大的網格狀結構;第三階段是復合物聚合產生絮狀沉淀。只有在抗原與抗體等價時即無過剩抗體,此時,復合物的結合與解離處于平衡狀態,其混濁程度達高峰。在抗體過量時,隨抗原量的增加而復合物形成也增加,其測定只能在反應曲線的左側進行(見圖18-4);③一般要求溶液中有非離子性親水多聚體促進免疫復合物的形成,如聚二乙醇6000等。溶液pH為6.5~8.0之間為宜。載脂蛋白有形成兩性螺旋片(amphipathic helix)的特性,對脂質(特別是磷脂)有高度親和力,與脂質結合后有時會掩蓋抗原位點或構象改變,可以部分或完全喪失對抗血清的特異反應。為此,載脂蛋白檢測過程中有必要先暴露抗原位點,所用試劑有表面活性劑,尿素,鹽酸胍和吐溫等解離蛋白劑,或用四甲基脲脫脂或有機溶劑脫脂等暴露抗原決定簇等方法,血清脂蛋白顆粒中的載脂蛋白,能在短時間內形成抗原抗體復合物進行定量;④抗原不能過量,因為抗原過量,抗原抗體復合物形成不但不增加,反而會減少,光散射或光吸收減少,檢測結果反而偏低。

圖18-4 抗原抗體反應曲線
在免疫比濁過程中,由于抗原抗體結合的三過程,從而導致光密度與濃度之間不呈線性關系,一般是3次方程曲線關系。若將抗原與抗體兩個變量之間的變動特征恰當地反映出來,需要經過3次方程擬合成近似直線化的曲線方程,再進行運算,免疫比濁中,采用終點法或速率法,用5個或7個不同梯度進行定標,經3次曲線方程求出一條能反映真實情況的濃度與光密度的關系曲線方程,才能作為定量的工作曲線。
二、血清ApoAⅠ(B100)透射比濁測定法脂蛋白抗原在溶液中與相應特異抗體形成抗原抗體復合物的混濁顆粒,分散于溶液介質中,在一定波長下測定其混濁程度,進行ApoAⅠ(B100)的定量測定。
(一)手工操作
1.原理
血清ApoAⅠ(B100)+抗人ApoAⅠ(B100)→抗原抗體復合物→測定光密度
2.試劑(伊利康)
(1)Apo緩沖液(RⅠ),含4%PEG6000和表面活性劑
(2)羊抗人ApoAⅠ(B100)抗體液(RⅡ):監用前取抗血清200μl,加0.9%NaCl液700μl,混勻,待用,置冰箱一周內有效。
(3)ApoAⅠ(B100)參考血清(RⅢ)
3.操作
(1)按ApoAⅠ抗血清液或ApoB100抗血清100μl,加相應的Apo緩沖液0.9ml的比例混合成單一試劑(Apo抗體液)。最好臨用前配制當天用量。
(2)各試劑用量如下表
| ApoAⅠ | ApoB100 | |||||
| 標準管 | 測定管 | 空白管 | 標準管 | 測定管 | 空白管 | |
| 參考血清 | 5μl | 5μl | ||||
| 待測血清 | 5μl | 5μl | ||||
| ApoAⅠ抗體液 | 1.0ml | 1.0ml | 1.0ml | |||
| ApoB100抗體液 | 1.0ml | 1.0ml | 1.0ml | |||
混勻各管,37℃保溫10min,波長340min,于半自動分析儀上先吸入空白管液,再吸入標準管,儀器根據光密度及參考值得出一換算系數,再吸入測定管,儀器內根據光密度及系數進行運算,打印結果。
(3)定標方法,根據免疫比濁法原理,應取多點(3~9點),按y=a+bx+cx2+dx3的3次方程回歸曲線進行定標,制作參考工作曲線。
①校正工作曲線的繪制:
配制抗血清稀釋工作液:按RⅠ試劑0.9ml,加RⅡ試劑100μl的比例(Apo抗體液)混勻,待用。
制備5點校正液:取RⅢ(參考血清),用0.9%生理鹽水倍比稀釋成5個濃度,第5管為原參考血清濃度,其他4管分別為第5管的1/2、1/4、1/8、1/16(或濃度為0即0.9%NaCl)。
表18-20 標準曲線制備的各管(點)濃度
| 管號 | 1 | 2 | 3 | 4 | 5 |
| 1號管(0)(μl) | 5 | ||||
| 2號管(1/8)(μl) | 5 | ||||
| 3號管(1/4)(μl) | 5 | ||||
| 4號管(1/2)(μl) | 5 | ||||
| 5號管(1/1)(μl) | 5 | ||||
| Apo抗體液(ml) | 1.0 | 1.0 | 1.0 | 1.0 | 1.0 |
混勻各管,置37℃水浴保溫10min,按程序上機作工作曲線。
②標本測定:吸待測血清(測定管)5μl,加上述稀釋抗血清工作液1.0ml,于37℃水浴保溫10min,上機讀數,打印結果。
③如測定值超過工作曲線上限值,儀器會打印顯示“過高”,此時,將待測標本稀釋1倍再測。
④每批號的抗血清應作一次多點定標,即測定標本的抗血清應與定標的抗血清是同一批號抗血清。
(二)生化分析儀測定
1.原理
脂蛋白抗原在溶液中與相應特異抗體形成抗原抗體復合物的混濁顆粒分散于溶液介質中,在一定波長下測定其混濁程度,進行ApoAⅠ(B100)的定量測定。
ApoAⅠ(B100)+抗人ApoAⅠ(B100)→抗原抗體復合物→測定吸光光密度
2.雙試劑單(雙)波長法
(1)試劑(溫州伊利康)
RⅠ:Apo緩沖液,含4% PEG6000和表面活性。
RⅡ:羊抗人ApoA(B100)稀釋抗血清
RⅢ:Apo定值血清
(2)各試劑及標本用量如下表:
| 項目 | 血清 | Apo緩沖液
(RⅠ) | ApoAⅠ抗血清液
(RⅡ) | ApoB100抗血清液
(RⅡ) |
| ApoAⅠ | 2~5μl | 300~350μl | 80~100μl | |
| ApoB100 | 2~5μl | 300~350μl | 80-100μl |
(3)定標:以5點Apo梯度濃度,采用免疫定標法按表18-21參數上機定標,如圖18-5所示。

圖18-5 ApoAⅠ 五點免疫定標曲線圖(以CL-7200儀器為例)
(4)上機(終點法或兩點法)

(5)說明:①Apo測定的光密度從340~700nm范圍都可采用,多用340nm;②國內已有的Apo試劑盒均無需處理;③血清標本也無需處理,均可直接檢測;④本法適用于多種類型的全自動生化分析儀檢測,自動扣除空白,快速準確;⑤效價不同的抗血清,其用量應作適當的調整。
(5)計算△A=A2-A1,以△A值采用免疫定標自動運算。
3.單一試劑單波長法
(1)試劑同雙試劑法
(2)標本及試劑用量:按ApoAⅠ抗血清液或ApoB抗血清液(RⅡ)100μl,加相應的Apo緩沖液(RⅠ)0.3ml的比例混合成單一試劑(Apo抗體液)。最好臨用前配制當天用量,此抗體液置2~8℃保存一周有效。
(3)定標:按五點梯度稀釋定值血清(見表18-21),以終點法或兩點法進行免疫定標。
(4)按以下步驟操作:

(5)以△A=A2-A1值按免疫定標自動運算。
(6)說明:①該法一般用半自動生化分析儀;②通過設延遲時間以扣除空白;③RⅠ、RⅡ試劑以臨用時混合為好,未用完的混合試劑應置于2~8℃冰箱保存,只允許使用一周;④血清標本無需再處理。
4.ApoAⅠ、AⅡ、B、CⅡ、CⅢ和E的全自動生化分析儀檢測的有關數據。
(1)上機參數(以CL-7200型為例)如表18-21所示。
表18-21 自動生化分析儀檢測Apo有關參數
| ApoAⅠ | AⅡ | B | CⅡ | CⅢ | E | |
| 反應類型 | 終 點法 | |||||
| 樣品量 | 3μl | 3μl | 3μl | 8μl | 3μl | 5μl |
| 測量波長 | 600nm(第一) | 數據 | 數據 | 700nm | 700nm | 700nm |
| 700nm(第二) | 數據 | 數據 | 340nm | 340nm | 340nm | |
| 反應時間 | 第一波長5min | 數據 | 數據 | 數據 | 數據 | 數據 |
| 第二波長4.99min | 數據 | 數據 | 數據 | 數據 | 數據 | |
| 試劑Ⅰ | 350μl | 290μl | 350μl | 300μl | 290μl | 350μl |
| 試劑Ⅱ | 100μl | 75μl | 100μl | 50μl | 75μl | 50μl |
| 單位 | g/L | g/L | g/L | mg/dl | mg/dl | mg/dl |
| 標準濃度點數 | 5 | 5 | 5 | 5 | 5 | 5 |
(2)標準曲線制備參數如表18-22所示。
表18-22 生化分析儀檢測Apo的定標濃度
| 標準管號 | 1 | 2 | 3 | 4 | 5 | 6 |
| 稀釋倍數 | 0 | 1:2 | 1:4 | 1:8 | 1:16 | 0 |
| ApoAⅠ度數(g/L) | 172 | 86 | 43 | 21.5 | 10.8 | 0 |
| ApoAⅡ度數(g/L) | 36 | 18 | 9 | 4.5 | 2.25 | 0 |
| ApoB濃度(g/L) | 180 | 91 | 45.5 | 22.6 | 11.3 | 0 |
| ApoCⅡ濃度(mg/dl) | 4 | 2 | 1 | 0.5 | 0.25 | 0 |
| ApoCⅢ濃度(mg/dl) | 5 | 2.5 | 1.25 | 0.63 | 0.31 | 0 |
| ApoE濃度(mg/dl) | 10 | 5 | 2.5 | 1.25 | 0.625 | 0 |
5.單一試劑和雙試劑檢測方法的比較
單一試劑和雙試劑在全自動生化分析儀測定的光密度變化過程,如圖18-6所示。
從理論上考慮任何一種生化測定方法的試劑,臨用時混合最好,可以消除試劑各種成份的自身化學變化和相互影響。而在實際工作中,是不可能的,只能是將幾種不會起化學反應而又無相互影響的試劑配制成2~4種,臨用時按一定比例配制使用。臨床化學試劑盒,目前主要以1或2種試劑形式供醫學檢驗使用,即單一試劑和雙試劑兩種形式。
筆者認為雙試劑比單一試劑好,尤其是含酶試劑和免疫試劑以雙試劑包裝形式為好,有利于對酶的活性或抗體效價的保存。單一試劑是所有試劑混合在一起,存放過程中,有可能因化學物質的存在而損害試劑中的工具酶或抗體,存放時間越長,損害可能性越大,然而雙試劑不存在這一問題。
對脂質的測定雙試劑法更顯其優越性,因為血清中脂質與載脂蛋白是以脂蛋白的形式存在,當測定試劑與血清標本混合后,首先解聯脂蛋白,讓其釋放出脂質和載脂蛋白,。作為免疫測定試劑還兼有使載脂蛋白抗原決定簇暴露的作用。當R1試劑作用完后,加進第二試劑(R2)后,使其抗體適應抗原決定簇的要求,達到抗原抗體結構呈完全的互補狀態,從而產生最大的抗原抗體結合量,達到定量的目的。雙試劑測定法,既能自動扣去空白,又能使化學反應快速進行,從而迅速地完成檢測的全過程。
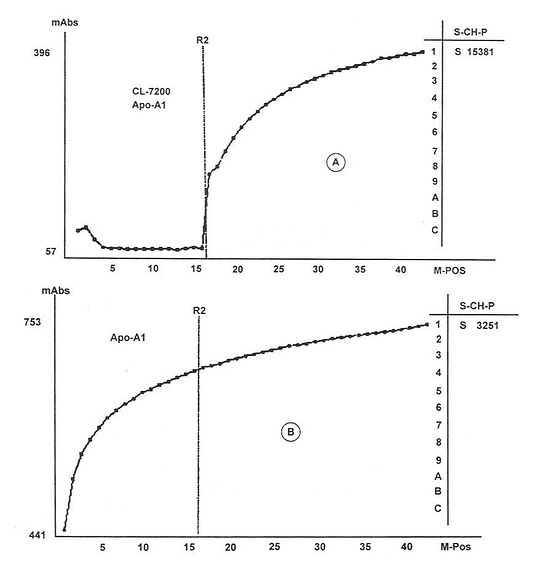
圖18-6 單雙試劑法反應過程的光密度變化曲線圖
A:雙試管法;B:為單一試劑法
(賀小玲 胡漢寧)
